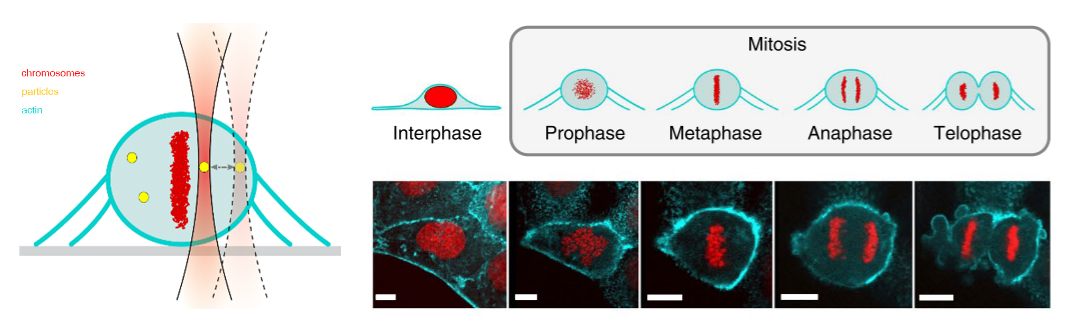
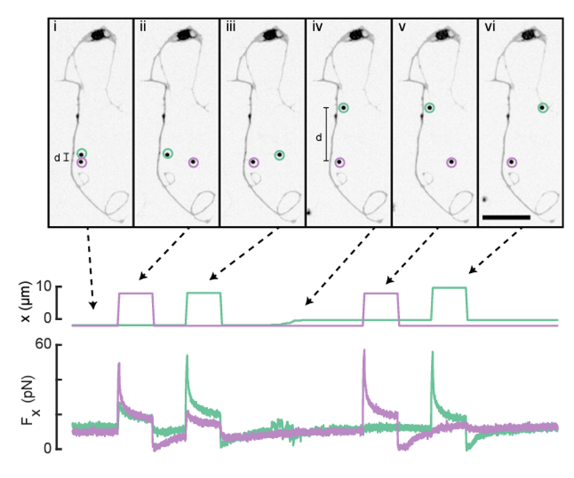
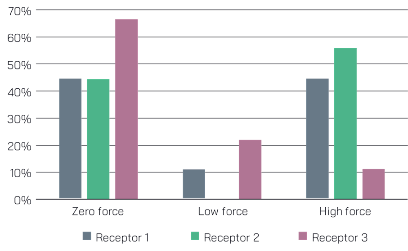
• Targeting ELOVL6 to disrupt c-MYC driven lipid metabolism in pancreatic cancer enhances chemosensitivity. Nature Communications (2025): https://doi.org/10.1038/s41467-025-56894-8
• Periodic Obstacles Regulate Membrane Tension Propagation to Enable Localized Mechanotransduction. Biorxiv (2025):https://doi.org/10.1101/2025.01.14.632796
• Measuring age-dependent viscoelasticity of organelles, cells and organisms with time-shared optical tweezer microrheology. Nature Nanotechnology (2025): DOI: 10.1038/s41565-024-01830-y
• Accessing activity and viscoelastic properties of artificial and living systems from passive measurement. Nature Materials (2024): https://doi.org/10.1038/s41563-024-01957-2
• A MEC-2/stomatin condensate liquid-to-solid phase transition controls neuronal mechanotransduction during touch sensing. Nature Cell Biology (2023): https://doi.org/10.1038/s41556-023-01247-0
• The laminin-keratin link shields the nucleus from mechanical deformation and signaling. Nature Materials (2023): https://doi.org/10.1101/2022.03.01.482474
• Intracellular softening and increased viscoelastic fluidity during division. Nature Physics (2021). https://doi.org/10.1038/s41567-021-01368-z
• An asymmetric mechanical code ciphers curvature-dependent proprioceptor activity. SCIENCE ADVANCES (2021) DOI: 10.1126/sciadv.abg4617
• The force loading rate drives cell mechanosensing through both reinforcement and fluidization. Nature Communications (2021). https://doi.org/10.1038/s41467-021-24383-3
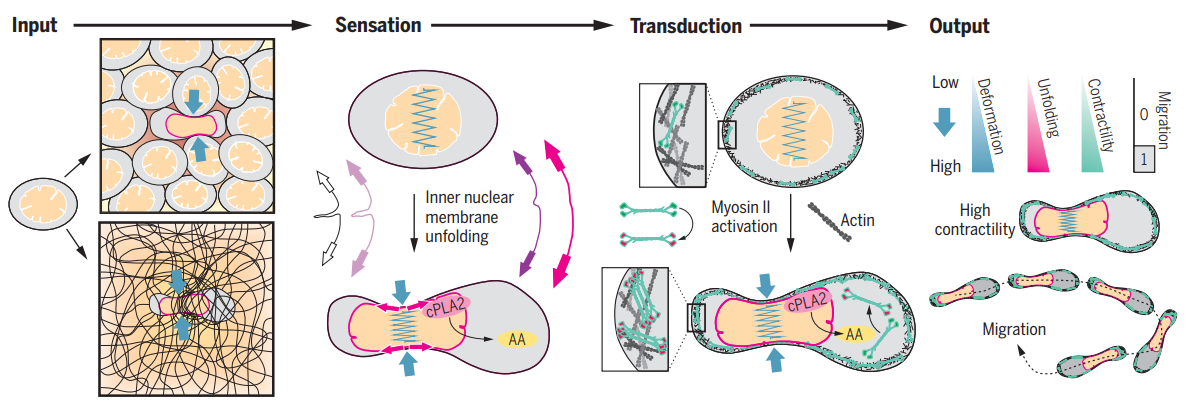
• The nucleus measures shape changes for cellular proprioception to control dynamic cell behaviour. SCIENCE (2020) DOI: 10.1126/science.aba2644