清华团队《ACS Nano》:仿生涂层攻克血栓顽疾,FluidFM技术揭开单细胞层面关键机制
发布日期:2026-01-13
心血管疾病已成为全球致死率最高的疾病,而血管支架、人工心脏瓣膜等血液接触类植入器械的血栓问题,一直是临床治疗的“致命短板”。近日,清华大学张洪玉教授团队在知名期刊《ACS Nano》发表重磅研究,凭借多功能单细胞显微操作FluidFM 技术(流体原子力显微镜)“单细胞精准捕获、黏附力定量测量、机制可视化验证” 的三大核心优势,突破性地从微观层面揭开涂层与血液细胞的相互作用奥秘,成功研发出仿细胞膜和儿茶酚胺化学的两性离子润滑涂层,实现抗凝与内皮化的协同突破,为解决植入器械血栓难题提供了兼具科学性与转化价值的全新方案,更让血液接触类器械的性能升级有了精准的技术支撑。

一、临床痛点:血液接触器械的“血栓魔咒”
当血管支架、人工心脏瓣膜等器械植入人体后,其表面容易吸附蛋白质、血小板,引发血栓形成;同时,器械还可能损伤血管内皮层,导致血管狭窄等并发症。为预防血栓,患者需长期服用抗凝药物,但这又会增加出血风险,尤其对糖尿病、小血管疾病患者而言,风险更高。
传统涂层要么侧重抗凝却不利于内皮细胞生长,要么稳定性差、制备复杂,难以兼顾“抗凝”与“内皮友好”两大核心需求。清华大学团队的研究,正是瞄准这一痛点,从自然界寻找灵感——红细胞膜的磷脂酰胆碱结构能形成稳定水合层,贻贝分泌的多巴胺则具备超强黏附能力,二者结合成为涂层设计的关键。
二、核心创新:“桥梁结构”仿生涂层,实现三重突破
团队设计合成了一种具有“桥梁结构”的嵌段共聚物PDMD(p(DMA-b-MPC-b-DMA)),通过简单的浸涂法即可修饰在镍钛合金(血管支架常用材料)、人工心脏瓣膜表面,其优势体现在三个方面:
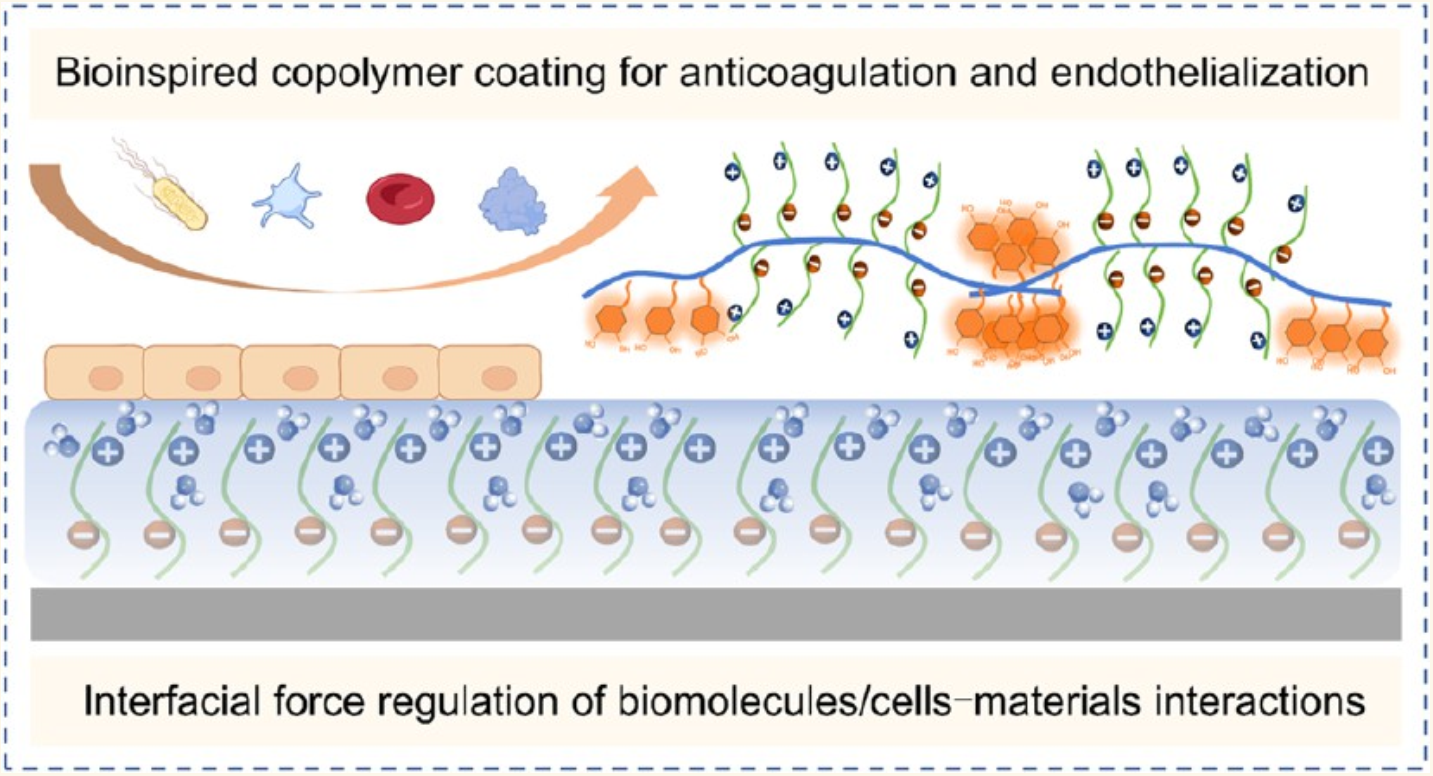
超强稳定性,与传统随机共聚物相比,PDMD的两端为多巴胺甲基丙烯酰胺(DMA)链段,中间为2-甲基丙烯酰氧基乙基磷酸胆碱(MPC)链段。DMA中的儿茶酚基团能通过金属-氧键、π-π堆积等多重作用,像“桥梁”一样将涂层牢牢固定在器械表面,解决了传统涂层易脱落、稳定性差的问题。石英晶体微天平(QCM-D)测试显示,PDMD涂层的吸附力是传统随机共聚物的1.95倍,且在模拟血液剪切力下仍能保持完整。
高效抗凝,MPC链段中的N⁺(CH₃)₃和PO₄⁻基团能通过偶极-电荷相互作用,吸附大量水分子形成致密水合层。这层水合层不仅能大幅降低器械表面摩擦系数(COF从0.191降至0.098),减少对内皮细胞的损伤,还能通过“水合排斥”作用,阻止血小板、蛋白质及细菌的吸附。体外实验表明,PDMD涂层对金黄色葡萄球菌和大肠杆菌的抗菌率分别达88.6%和92.4%,血小板吸附量较未修饰表面降低90%以上。
内皮友好,涂层虽能排斥血小板和红细胞,却不影响内皮细胞的正常黏附和增殖。兔颈动脉支架植入实验显示,1个月后PDMD修饰的支架表面形成了完整的内皮细胞层,且无明显炎症和血栓;而未修饰支架则出现血管闭塞。在绵羊人工心脏瓣膜实验中,PDMD涂层瓣膜在70天内无需额外抗凝治疗,血流动力学参数正常,左心室射血分数保持在75%以上,远超传统瓣膜性能。
三、技术关键:FluidFM技术揭示单细胞层面的“力控机制”
如果说仿生涂层是解决血栓问题的“核心方案”, FluidFM技术就是揭秘其作用机制的“关键利器”。传统方法难以精确测量单个细胞与材料表面的相互作用力,而FluidFM(流体原子力显微镜)通过“负压吸附”技术,能精准捕获单个内皮细胞、红细胞或血小板,直接量化它们与涂层表面的黏附力,为涂层的抗凝-内皮化协同机制提供了可视化、定量化证据。
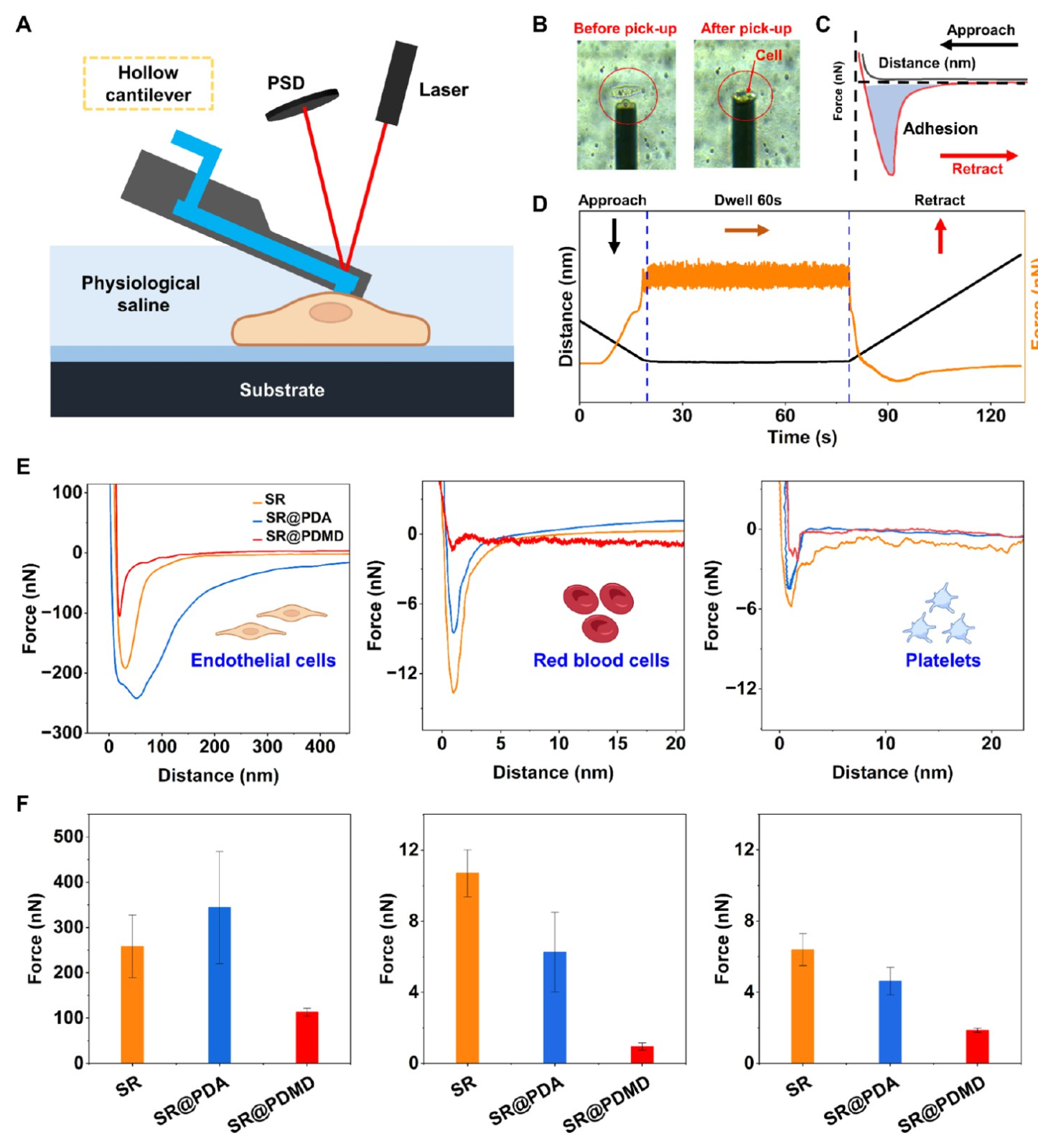
1.创新实验设计:FluidFM像“吸管”一样抓细胞测力
研究中,团队将FluidFM的无针尖悬臂梁通过微通道施加负压,将单个细胞(内皮细胞、红细胞或血小板)固定在悬臂梁顶端(图A、B)。随后,控制悬臂梁靠近涂层表面并停留60秒,再缓慢撤回,同时记录力-距离曲线(图C、D)。曲线中的峰值力代表细胞与表面的最大黏附力,曲线下面积则反映黏附能量。
2. 突破性发现:涂层对不同细胞的“力控差异”
FluidFM测试结果显示:对红细胞和血小板:PDMD涂层表面的黏附力仅约2nN,远低于未修饰表面(红细胞约12nN,血小板约12nN),这解释了涂层为何能有效排斥血栓形成的关键细胞;对内皮细胞:PDMD涂层表面的黏附力虽低于未修饰表面(113.6nN vs 258.1nN),但显著高于红细胞和血小板(约56倍)。这种“选择性黏附”确保了内皮细胞能正常附着并形成保护层,而血小板和红细胞则被排斥,正是涂层实现“抗凝”与“内皮化”协同的核心机制。
四、临床意义:推动血液接触器械升级换代
这项研究不仅提出了一种性能优异的仿生涂层,更通过FluidFM技术建立了“材料表面-单细胞作用力-临床效果”的关联,为血液接触类器械的表面设计提供了全新范式。未来,该涂层可广泛应用于血管支架、人工心脏瓣膜、血液透析管路等器械,有望减少患者对长期抗凝治疗的依赖,降低出血风险,同时提高器械的长期安全性和有效性。
清华大学团队的这项研究,既是仿生材料设计的突破,也是单细胞力学表征技术的成功应用。FluidFM作为“微观力学家”,让我们首次看清了细胞与材料相互作用的“细节”,而这种“从宏观效果到微观机制”的研究思路,也为更多生物材料的研发提供了重要借鉴。

如果您想获取上述文章和FluidFM技术相关资料,请拨打电话:010-85120280,或扫描下方二维码获取!

扫描上方二维码,获取您想了解的信息!


