解码 GLP1R 纳米结构域!大视野单分子超分辨系统登 Cell Metab等高水平期刊,解锁胰岛素调节新通路
发布日期:2025-12-23
在细胞生物学、神经科学等前沿研究领域,分辨率不足、流程繁琐、数据碎片化一直是制约科研突破的核心痛点。传统成像技术难以捕捉纳米尺度的分子细节,而复杂的样品制备、设备兼容难题和低效的数据分析,更让科研人员陷入 “耗时耗力却难出成果” 的困境。法国Abbelight公司的大视野单分子超分辨系统,以 “全流程一站式解决方案” 打破行业壁垒,兼容现有设备、操作简单高效、成像精准,从样品制备到深度分析全程护航,让纳米级科研探索不再受限!
值得一提的是,英国牛津糖尿病、内分泌学和新陈代谢中心 David Hodson 研究组借助 Abbelight SAFe 180 大视野单分子超分辨系统,将分辨率从200 nm 提升至 20 nm,成功揭示胰高血糖素样肽 - 1 受体(GLP1R)在 β 细胞 -α 细胞界面的纳米结构域富集特征,阐明了胰高血糖素调节胰岛素释放的关键通路,为替尔泊肽等药物的作用机制研究提供了核心技术支撑。
核心优势:全流程革新,重塑超分辨成像体验
一站式解决方案,无需拼凑全程无忧
从样品制备到成像采集,再到结果分析,Abbelight 提供覆盖全流程的集成化方案,彻底告别 “多设备适配难、实验环节断层” 的烦恼:
样品制备:即用型 SMART 系列试剂盒(染色、外泌体、缓冲液、上样等)+ 自动化微流系统,无需复杂操作,即可实现细胞培养到成像的无缝衔接,结果稳定可重复;
成像采集:SAFe 多模态成像平台,兼容所有倒置显微镜(图示为与 Evident IX83 系统组合),模态切换耗时小于 1 分钟,轻松满足不同实验需求;
结果分析:Neo 专业软件加持,实现纳米尺度图像呈现与定量分析,数据直接服务于研究结论,无需额外工具二次处理。
性能拉满,解锁成像新极限
更大视场:150µm×150µm 超大均一成像视野,远超同类产品,一次性捕获更多样本细节;
更快速度:512×512 像素下最高可达 300fps,高效采集不拖沓;
更准分辨率:20nm 超高分辨率,突破传统显微镜局限,清晰呈现分子级结构;
更多功能:支持多通道 3D 成像、单分子定位 3 色成像及 TIRF 模式 4 色成像,自动切换 EPI、HiLo、TIRF 照明模式,满足神经科学、微生物学、基因组学等多领域研究需求。
灵活兼容,降低科研投入门槛
无需淘汰现有设备!SAFe 成像平台可无缝兼容实验室已有的倒置显微镜、相机及激光系统,搭配可升级、可定制的扩展模块,既能最大化利用现有资源,又能根据研究需求灵活拓展功能,以最小投入获得优质实验产出。

大视野单分子超分辨系统
实力护航科研成果突破
胰岛由各种不同类型细胞组成,胰腺α细胞通过释放胰高血糖素以旁分泌方式调节β细胞功能以释放胰岛素。然而,α细胞对β细胞调节背后的详细分子机制仍未充分阐明。
英国牛津糖尿病、内分泌学和新陈代谢中心的David Hodson的研究组使用Abbelight SAFe 180大视野单分子超分辨系统,通过直接随机光学重构显微成像(dSTORM)成像发现胰高血糖素样肽-1受体(GLP1R)在与α细胞接触的β细胞膜上以纳米结构域形式富集,完成了胰腺激素分泌调控的关键研究,相关成果发表于《Cell Metabolism》及《Nature Metabolism》高水平期刊上。
由于光学显微镜存在衍射极限,因此研究组采用了dSTORM成像,以便在β细胞-α细胞界面对GLP1R进行单分子级别的定量检测(图1A,B)。研究组使用了喂食标准饲料的GLP1RSNAP/SNAP小鼠胰岛,这些小鼠在GLP1R的N端敲入了SNAP-tag酶自标记,从而可以报告内源性GLP1R。由于GLP1R是β细胞特异性标志物,GLP1R阳性和阴性可分别用于鉴定β细胞和α细胞。胰岛使用BG-SulfoCy5进行标记,在dSTORM成像中表现出极佳性能。研究组拍摄了约40,000帧图像,并进行了GLP1R定位重构,dSTORM成像将分辨率从光学显微镜的约150 nm提高到了约30 nm,以超高的细节展示了β细胞-α细胞界面的GLP1R,显示GLP1R在β细胞与α细胞之间的膜上富集(图1C)。接下来,研究人员使用了Abbelight软件内置的基于密度的噪声应用空间聚类(DBSCAN)分析来识别包含≥8个定位点的簇,这些簇被视为单个GLP1R。通过这种方式,发现在β细胞-α细胞界面检测到GLP1R纳米结构域形成增加(图1D–1F),这是GPCR高级组织形式和信号传导的一个特征。

图1 β细胞-α细胞界面GLP1R纳米结构域的dSTORM单分子定量分析[1]
为探究α细胞→β细胞信号传导对GLP1R纳米结构域形成的作用,研究人员使用基于Cy5的荧光的GLP1R拮抗剂LUXendin645重复了实验。结果显示, LUXendin645处理后,拮抗/未刺激状态的GLP1R仍可在纳米尺度下被观测到(图1H)。然而,在经LUXendin645处理的样本中,邻近α细胞的β细胞与其他β细胞相比,未观察到聚类参数存在差异(图1H–1L),表明α细胞分泌产物与GLP1R结合并部分驱动了局部GLP1R纳米结构域的形成。
研究组通过进一步的研究发现,在低葡萄糖条件下,邻近α细胞的β细胞通过预内化GLP1R直接感知释放的胰高血糖素。与邻近其他β细胞的β细胞相比,邻近α细胞的β细胞分泌能力更强,而在代谢应激期间,β细胞与α细胞之间的GLP1R接触会减少,最终详细地阐述了胰高血糖素调节胰岛素释放的一条受调控通路。
先前研究发现,除了GLP1以外,葡萄糖依赖性促胰岛素多肽(GIP)也能够强效增强胰岛素分泌并影响饱腹感,从而减少食物摄入。GLP1R/GIPR双重激动剂(如替尔泊肽)疗效显著,但其具体的细胞作用底物尚不清楚。由于受体低丰度及缺乏可靠抗体,免疫组化可视化面临挑战;现有转基因模型亦无法反映药物的具体结合情况。此前的单一受体探针难以推断双重激动剂的结合位点,而已有的荧光替尔泊肽缺乏特异性验证。因此,目前亟需开发经过验证的特异性探针,以可视化并阐明双重激动剂在胰腺和大脑中的作用机制。
研究组分别合成并验证了分别装有Cy3和Cy5的daLUXendin544和daLUXendin660,即红色和远红外GLP1R/GIPR双重激动剂探针。纳摩尔浓度的daLUXendin特异性标记活细胞中的GLP1R/GIPR,使得双重激动剂(如替尔泊肽)的内源性结合位点和细胞靶点得以可视化和探究。
GPCR在细胞膜和细胞内会形成对信号传导很重要的纳米结构域。因此,研究人员为确定在胰岛中,单一激动剂与双重激动剂如何靶向内源性GLP1R/GIPR纳米结构域,首先使用了LUXendin645(一种偶联Cy5的GLP1R拮抗剂)建立了未受刺激但结合状态下的纳米结构域组织。在与LUXendin645孵育60分钟、固定并对整个胰岛进行dSTORM成像后,证实未受刺激的GLP1R形成离散的纳米结构域(图2a,b)。GIPR激动剂sGIP648也标记了离散的受体纳米结构域(GIPR),然而,与单独的GIPR激动剂相比,daLUXendin660密集标记了胰岛中的GLP1R/GIPR纳米结构域,超出了单独使用GIPR激动剂的效果,因此,daLUXendin660可能影响GLP1R聚类或GLP1R和GIPR定位以增加纳米结构域的形成(图2b–d)。每个簇的定位数以及每个簇的密度在所有检查的配体中均相似(图2e,f)。细胞纳米结构域内或之间的GIPR和GLP1R信号传导,而不仅仅是细胞质中的简单信号叠加,促成了替尔泊肽的功效。
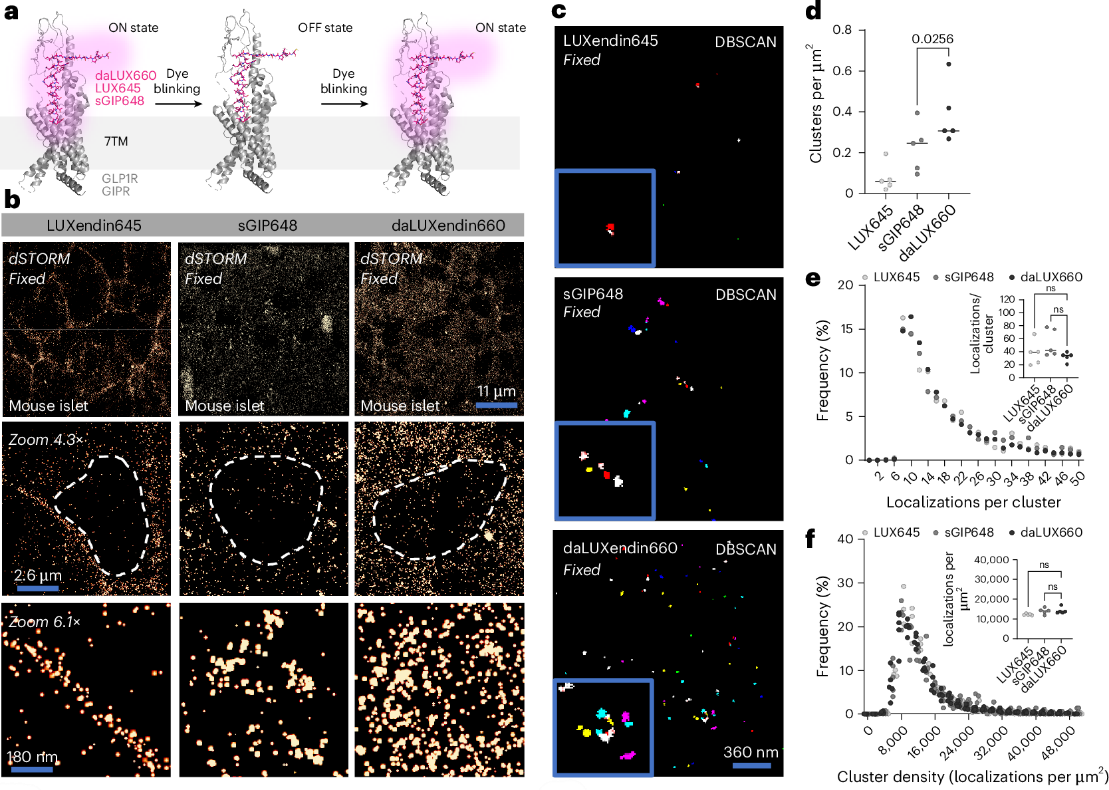
图2双重激动剂参与的不同的内源性GLP1R/GIPR纳米结构域[2]
经过多项实验验证,可以确认daLUXendin544/660是高度特异性的探针,可突出显示复杂组织(如胰岛和大脑)中的双重激动剂靶细胞,为解析双重激动剂疗效机制提供了关键工具。
Abbelight的dSTORM成像技术凭借大视野成像优势,突破传统光学显微镜衍射极限,实现超高分辨率成像,可在单分子水平上对GLP1R等膜蛋白进行精确定位和定量检测;软件自带的DBSCAN聚类分析算法,能够从复杂的定位数据中精准地识别出受体的纳米结构域,并提供详细的量化参数,有效区分受体在不同生理状态下的组织形式差异,为分子机制阐明提供坚实技术支撑。
参考文献:
[1] Tong, J. C., Frazer-Morris, C., Shilleh, A. H., Viloria, K., de Bray, A., Nair, A. M., ... & Hodson, D. J. (2025). Localized GLP1 receptor pre-internalization directs pancreatic alpha cell to beta cell communication. Cell Metabolism, 37(8), 1698-1714.
[2] De Bray, A., Roberts, A. G., Armour, S., Tong, J., Huhn, C., Gatin-Fraudet, B., ... & Hodson, D. J. (2025). Fluorescent GLP1R/GIPR dual agonist probes reveal cell targets in the pancreas and brain. Nature metabolism, 1-14.


