突破液相无标记观测瓶颈!纳米光谱与成像系统揭秘纳米药物载体实时调控机制,成果登Nature 子刊
发布日期:2025-09-03
引言
在纳米药物递送系统研发中,脂质囊泡的光控释药性能直接决定靶向治疗效果。然而,传统技术难以在生理液相环境中实现单颗粒、无标记、高时空分辨率观测,导致光控载体形变机制与药物释放协同过程长期处于“黑箱”状态。这一瓶颈严重阻碍了精准药物递送系统的优化进程。
近日,纳米药物研究领域迎来一项重要突破,德国慕尼黑大学(LMU)物理系的 A. Tittl、T. Lohmüller、F. Keilmann 研究团队依托neaSCOPE纳米光谱与成像系统的s-SNOM-Nano-FTIR 开发的瞬态红外纳米成像技术,突破性的在水性环境中实现对单个脂质囊泡(最小尺寸 176 nm)光异构化动态的无标记、非破坏性观测,其 20 nm 的超高空间分辨率与 30 ms 的超快时间分辨率,成功打破传统技术瓶颈,为解析纳米药物载体动态机制提供了革命性工具。该成果以“Transient infrared nanoscopy resolves the millisecond photoswitching dynamics of single lipid vesicles in water”为题发表于《Nature Communications》上。
核心优势:攻克液相观测技术难题
此次研究的关键突破源于 neaSCOPE的s-SNOM-Nano-FTIR技术,针对液相环境观测设计的四大核心配置,准确解决了传统技术在生理环境下研究软物质的痛点:
微流控液池,配备约10-20 nm厚度的薄膜光学窗口;
可在液体环境中实现原位的近场纳米光谱和成像测量(支持s-SNOM&nano-FTIR;
定制泵系统,含2个储液罐及配套组件,配备高精度流量控制单元,实现精准压力调控;
支持气体接入,如氮气等保护气体供应。
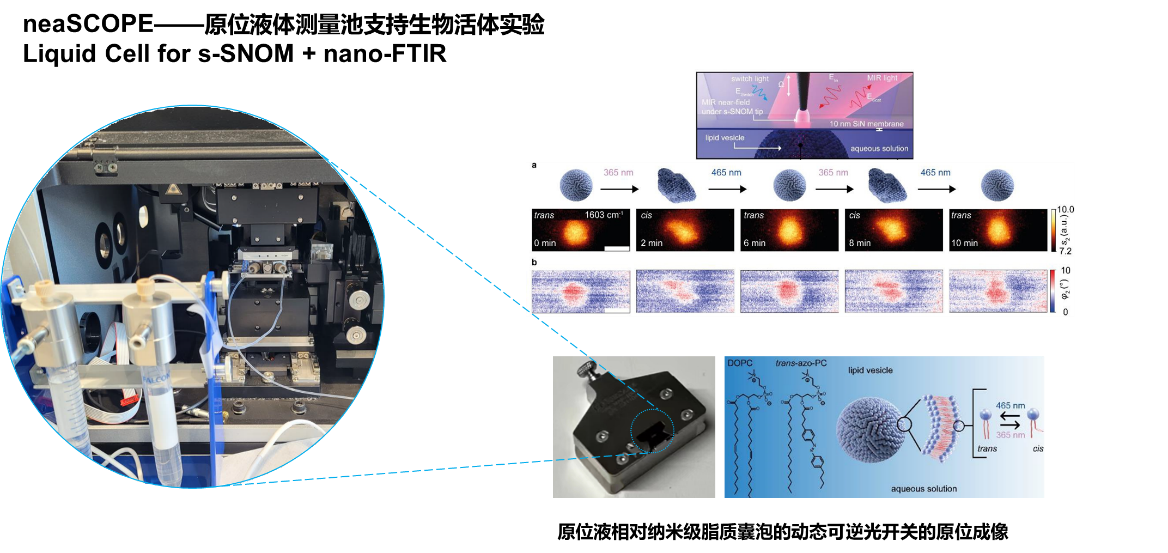
研究核心发现:单囊泡水平揭示光控动力学机制
依托 neaSCOPE的s-SNOM-Nano-FTIR的技术优势,研究团队采用特殊的超薄SiN膜液腔技术,突破水环境观测限制(图1a),在单脂质囊泡光控行为研究中取得三大关键发现,首次揭开偶氮苯类光开关脂质(azo-PC)动态机制的 “黑箱”:
20 nm超高空间分辨:穿透液膜精准捕捉囊泡形变(图1e);
30 ms瞬态追踪:采样速度比传统AFM快100倍;
化学指纹无损识别:nano-FTIR光谱区分trans/cis异构态(图1f)。
这一技术突破使得在水环境(如生理溶液或细胞培养液)中直接观测软物质系统成为可能,并支持多模态联用,包括Nano-FTIR光谱分析、瞬态追踪和化学成像。

图1. s-SNOM水环境单囊泡研究纳米红外光谱/化学成分表征
光控形变可视化
如下图2所示,通过1603 cm-1波长动态成像,该团队首次捕捉到光诱导囊泡面积扩张10 %(trans→cis态)。形变圆度分析揭示膜圆度变化规律(图2d),为药物释放通道设计提供直接依据。

图2. 可逆光控形变成像
毫秒级协同动力学
固定探针于单囊泡中心,以500 ms采样速度追踪8次光切换循环(图3b, e),成功解析了协同动力学特征:
延迟突变效应:发现trans→cis转换存在10-15秒滞后期;
协同切换特征:捕获到具有τ=0.7-3.9 s的S形响应曲线(图3b红色拟合线)。
证明脂质分子在膜环境中存在位阻-协同转换机制,为可控释药时序设计提供关键参数。
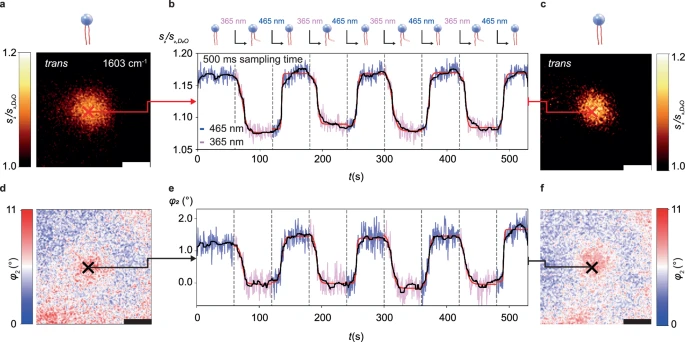
图3. 毫秒级动力学追踪
应用价值
该研究成果对纳米药物研发具有重大意义,有潜力助力药物研发瓶颈突破:
载体优化:量化形变-释药关联性,加速光控脂质纳米粒子设计;
稳定性预测:通过膜圆度变化评估药物或分子制剂的体内行为;
工艺调控:协同动力学参数指导脉冲释药系统开发。
neaSCOPE技术引领液相纳米观测新方向
此次德国慕尼黑大学团队的研究成果,再次印证了neaSCOPE纳米光谱与成像系统的s-SNOM-Nano-FTIR在液相软物质高分辨成像领域的的核心价值,其20 nm空间分辨率、30 ms瞬态追踪、无标记化学识别能力,以及微流控液池、气体保护等定制化配置,共同构建了 “原位、动态、精准” 的液相纳米观测体系。未来,随着该技术在纳米医药、生物材料等领域的进一步应用,有望持续解锁更多微观动态机制,实现高效&精确的靶向药物递送。
参考文献:
[1]. Gölz, T., Baù, E., Zhang, J. et al. Transient infrared nanoscopy resolves the millisecond photoswitching dynamics of single lipid vesicles in water. Nat Commun 16, 6033 (2025). https://doi.org/10.1038/s41467-025-61341-9


