“冻”中有静,细思极“孔” ——Moorfield薄膜生长设备助力冷冻电镜研究新进展登上Science
发布日期:2021-11-30
科研进展
Moorfield薄膜生长设备的用户英国剑桥大学Christopher J. Russo教授研究组利用高质量的薄膜生长与加工技术制备了用于冷冻电镜样品制备的“HexAuFoil”金属网,该金属网使得冷冻电镜观察生物大分子样品时样品的位置漂移小于1埃米,进一步提高了冷冻电镜的成像质量,该结果刊登在2020年10月的Science杂志上。“HexAuFoil”金属网制备过程中的关键环节就是采用Moorfield提供的高精度电子束蒸发技术以及液氮冷却的低温样品台,使得Au膜当中的粒径更小,在缩小金属网圆孔直径的情况下仍保证了金属网孔的圆度和质量。

图1:生长在Si 片上的“HexAuFoil”金属网阵列
(图片由分子生物学MRC实验室的Neil Grant提供)
说到冷冻电镜,近几年在分子生物学方向可谓是大放异彩,我国生物学家利用冷冻电镜技术在结构生物学方面也做出了许多举世瞩目的重要成果。冷冻电镜技术几乎的实现了对生物大分子的高精度观察。但在实际应用中仍有很多因素限制了冷冻电镜观测精度的进一步提升。其中重要因素之一是由于电子束照射导致金属网上的玻璃态的水膜发生移动从而影响观测精度。英国剑桥大学的Christopher J. Russo研究组对金属网上玻璃态水膜的移动建立了物理模型,通过分析得出水膜的直径和厚度存在一个临界比值,超过临界比值,水膜在快速冷冻过程中会由于应力作用发生弯曲,并有部分应力冻结在内部。而在电子束照射时,由于电子束照射作用提高了水膜中水分子的扩散系数(~1046倍),玻璃态的水膜便成为了一个“超粘流体”,水膜的应力会进一步的释放使得水膜的曲率发生变化,从而导致了生物大分子的位移,而这个位移只发生在电子束照射时,从而影响成像质量。
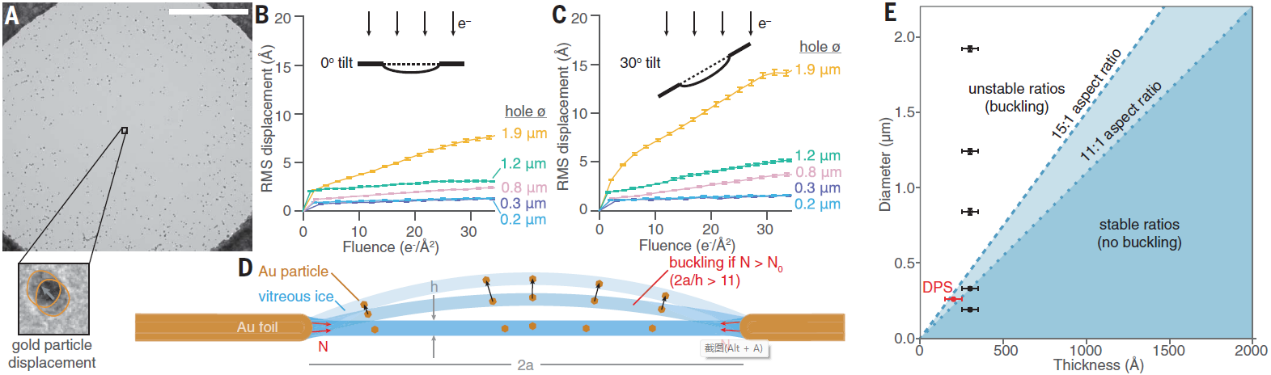
图2:A冷冻电镜在观测时样品的位置移动,B、C不同角度,不同孔径对位移的影响,D水膜曲率变化导致样品位移的示意图。E孔径比的临界值(孔的直径/水膜厚度)
如果缩小金属网孔的直径,使水膜的直径和厚度比值在临界以内,在冷冻时水膜内聚集的能量不足以使水膜发生弯曲,电子束照射的能量也不会引发水膜曲率的变化,仅仅会引起水分子的扩散,而扩散对成像的影响远小于曲率的变化。从而可以提高冷冻电镜的成像质量。因此制备高精度小孔径金属网格就显得尤为重要。Christopher J. Russo课题组利用了高精的光刻和电子束蒸发薄膜制备技术在硅片上成功的批量制备出了孔径在200 nm尺度的金属支撑网,使得冷冻电镜测量时样品的位移小于1埃米。

图3:利用“HexAuFoil”金属网的冷冻电镜观测结果
后作者利用制备的“HexAuFoil”金属网对223-kDa DPS蛋白质进行了冷冻电镜的观测。结果表明,采用“HexAuFoil” 金属网可以有效减小样品的移动,使得分辨率轻松突破2埃米(更多细节请参考原文)。该篇文章介绍了一种减小样品位置漂移提高冷冻电镜精度的有效途径。
Moorfield薄膜制备与加工设备
Moorfield Nanotechnology是英国材料科学领域高性能仪器研发公司,成立26年来专注于高质量的薄膜生长与加工技术,拥有雄厚的技术实力,推出的多种高性能设备受到科研与工业领域的广泛好评。Moorfield公司近十年来与曼彻斯特大学诺奖技术团队紧密合作,推出的台式高精度薄膜制备与加工系列产品由于其体积小巧、性能、易于操作更是受到很多科研单位的赞誉。Moorfield Nanotechnology推出的大型系列设备具有更大的配置自由度,可以满足各种用户的特殊功能需求,并且接受设备的特殊定制化设计。
冷冻电镜背景介绍
2017年诺贝尔化学奖颁给了发明冷冻电镜(Cryo-EM)的三位科学家,哥伦比亚大学教授Joachim Frank、苏格兰分子生物学家和生物物理学家Richard Henderson、以及瑞士洛桑大学生物物理学荣誉教授Jacques Dubochet以表彰他们在冷冻显微术领域的贡献。严格来说,其实这次化学奖是颁发给了三维“物理学家”以表彰他们对生物领域做出的贡献。Richard Henderson在20世纪90年代改进了电子显微镜,实现了原子级分辨率;Joachim Frank在70、80年代开发了一种图像合成算法,能将电子显微镜模糊的二维图像解析合成清晰的三维图像;Jacques Dubochet发明了迅速将液体水冷冻成玻璃态以使生物分子保持自然形态的技术。这些发明使低温冷冻电子显微镜得到很大的优化。
为什么观察蛋白质等生物大分子需要冷冻电镜呢?这是由于蛋白质等生物大分子往往只能保存在水溶液中无法满足电镜的真空要求,并且这些生物大分子是通过氢键链接的,电子的轰击会导致氢键断裂破坏分子结构,此外蛋白质等活性物质是运动的,不是一个静止状态。由于以上原因,普通电镜是不能用于观察蛋白质等生物活性物质的。科学家们经过探索发现,快速冷冻可使水在低温状态下呈玻璃态,减少冰晶的产生(水凝结成冰晶体积会膨胀从而会破坏生物分子结构),从而不影响样品本身结构,生物大分子就可以冷冻在这个玻璃态的水里,通过冷冻传输系统保证在样品始终保持在低温状态下,这样就可以对样品进行电镜观察了。然后利用计算软件通过大量的二维照片解析出生物大分子的三维结构,这便实现了对生物大分子的高精度观测。
近些年来,冷冻电镜在结构生物学领域大放异彩,使得对蛋白质等生物大分子的研究取得了长足的发展。我国生物学家去年在新冠病毒研究方面取得的诸多进展中也有很多重要的工作都用到了冷冻电镜技术。
【参考文献】
[1]. Naydenova K , Jia P , Russo C J . Cryo-EM with sub–1 specimen movement[J]. Science, 370.


