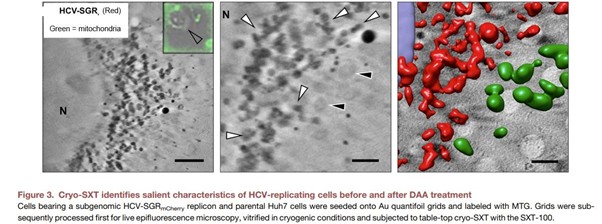
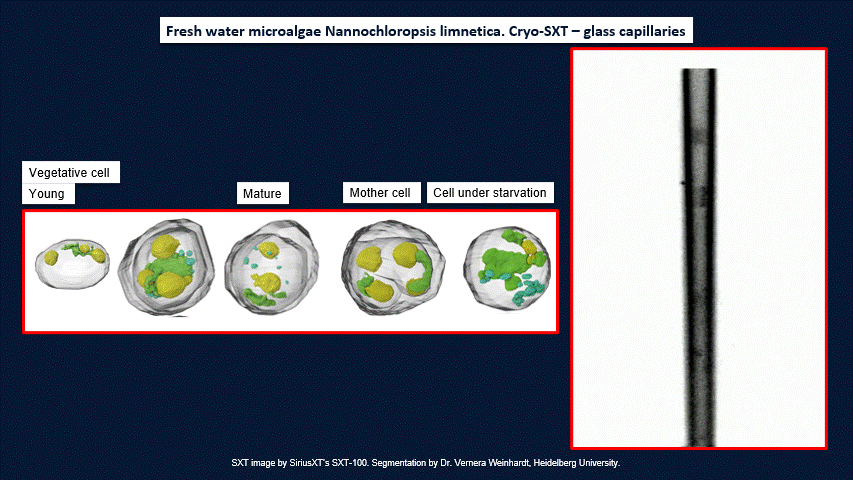
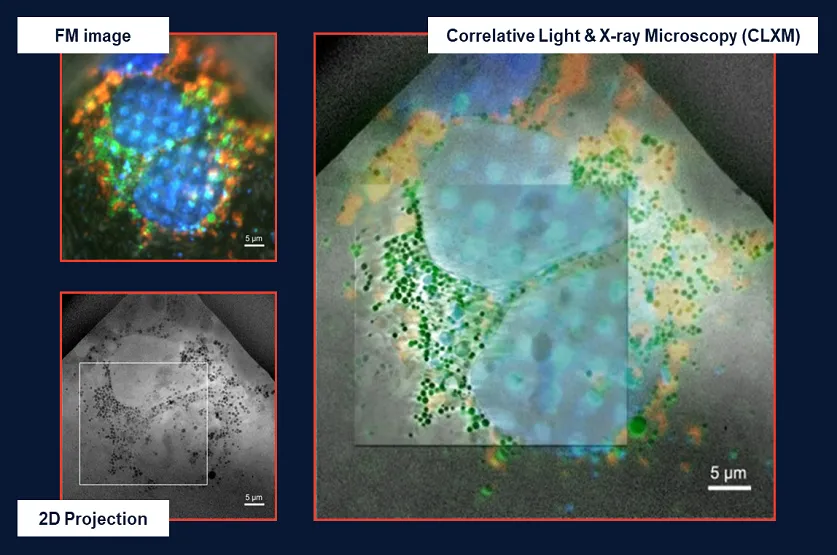
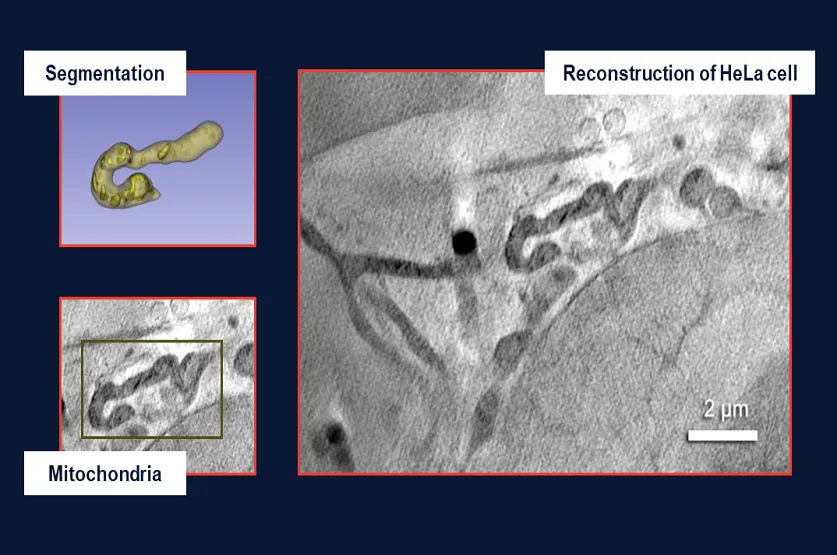
• Fahy, K., Kapishnikov, S., Donnellan, M., McEnroe, T., O'Reilly, F., Fyans, W., & Sheridan, P. (2024). Laboratory based correlative cryo-soft X-ray tomography and cryo-fluorescence microscopy. Correlative Light and Electron Microscopy V, 293.
• Fahy, K., Weinhardt, V., Vihinen-Ranta, M., Fletcher, N., Skoko, D., Pereiro, E., ... & McEnroe, T. (2021). Compact Cell Imaging Device (CoCID) provides insights into the cellular origins of viral infections. JPhys Photonics, 3(3).
• Kapishnikov, S., Hempelmann, E., Elbaum, M., Als‐Nielsen, J., & Leiserowitz, L. (2021). Malaria pigment crystals: The achilles′ heel of the malaria parasite. ChemMedChem, 16(10), 1515-1532.
• Kapishnikov, S., Staalsø, T., Yang, Y., Lee, J., Perez-Berna, A. J., Pereiro, E., ... & Als-Nielsen, J. (2019). Mode of action of quinoline antimalarial drugs in red blood cells infected by Plasmodium falciparum revealed in vivo. Proceedings of the National Academy of Sciences, 116(46), 22946-22952.
• Kapishnikov, S., Leiserowitz, L., Yang, Y., Cloetens, P., Pereiro, E., Awamu Ndonglack, F., ... & Als-Nielsen, J. (2017). Biochemistry of malaria parasite infected red blood cells by X-ray microscopy. Scientific reports, 7(1), 802.