人类诱导多能干细胞(hiPSCs)的单细胞克隆
人类诱导多能干细胞(hiPSCs)构建单克隆细胞系培养步骤繁琐,细胞对异常的处理和操作非常敏感,传统单细胞分选容易导致细胞和遗传毒性应激的积累,进而导致不良分化和多能性丧失。
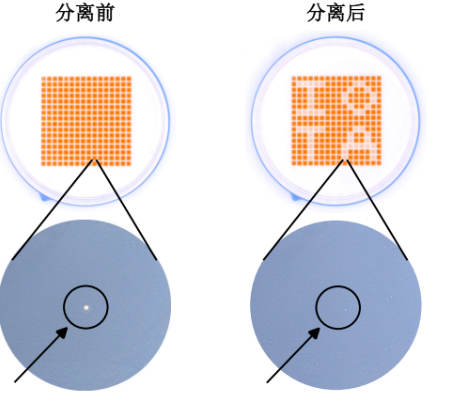
使用isoCell可以温和且自动化地将人类诱导多能干细胞(hiPSCs)进行单细胞分选并进行培养,高效地培养hiPSCs单克隆细胞系,显著提高了细胞分离与克隆效率(如下图所示)。

K562细胞单细胞测序
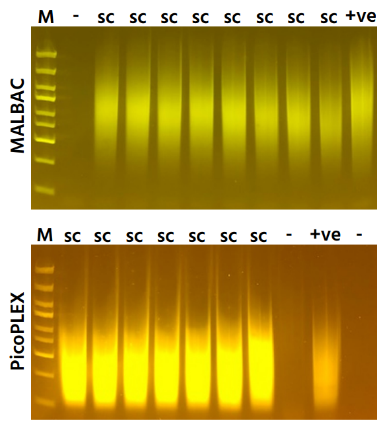
传统单细胞测序需对单细胞进行全基因组扩增(WGA),但传统单细胞WGA受限于如何获得单个细胞并转移到小体积的WGA反应中。
使用isoCell自动将K562细胞拾取并转移至含3.5 µl scWGA试剂的PCR管中,并无缝衔接scWGA反应。琼脂糖凝胶电泳结果显示(下图),单细胞WGA的DNA样本(+)中两种基因均被特异性扩增,而阴性对照(-)没有这两种扩增产物,符合预期。

对人类诱导多能干细胞 (hiPSCs) Prime 编辑构建工程细胞系
Prime 编辑可在 HEK3 基因座中高效精确插入三个核苷酸,用于构建工程细胞系hiPSCs。通过引入靶标特异性 pegRNA 来编辑单个或多个基因组位点,以进行精确有效的基因组编辑,促进疾病建模和功能遗传学研究。

Prime 编辑使用与逆转录酶融合的 Cas9 切口酶,将 DNA 序列从“Prime 编辑”引导 RNA (pegRNA) 复制到特定基因座。通过Prime 编辑将多西环素诱导型 Prime Editor 蛋白 (PE2) 整合到 iPSC 细胞系的AAVS1 基因组,之后使用isoCell分选转入靶基因的hiPSCs细胞系,以确保细胞的单克隆性。(见上图)
该研究使用isoCell来确保工程细胞系的单克隆性与准确性。
参考文献:Bharucha N, Ataam J A, Gavidia A A, et al. Generation of AAVS1 integrated doxycycline-inducible CRISPR-Prime Editor human induced pluripotent stem cell line[J]. Stem Cell Research, 2021, 57: 102610.
胶质母细胞瘤(GBM)通过表观遗传免疫编辑获得骨髓相关转录程序以引发免疫逃逸
研究人员通过将多形性胶质母细胞瘤干细胞 (GSC) 连续移植到免疫活性宿主中,发现 GSC 通过建立增强的免疫抑制肿瘤微环境来免疫逃逸。从机制上讲,GSC通过表观遗传免疫编辑过程引起,其在免疫攻击后强制执行 GSC 中稳定的转录和表观遗传变化。研究中使用Irf8敲除细胞系实验证明,Irf8的激活是细胞免疫逃逸的一个重要因素,且在体内可能通过IFNγ介导的激活发生。该研究使用isoCell构建Irf8克隆敲除系。

参考文献:Gangoso E, Southgate B, Bradley L, et al. Glioblastomas acquire myeloid-affiliated transcriptional programs via epigenetic immunoediting to elicit immune evasion[J]. Cell, 2021, 184(9): 2454-2470. e26.