外泌体粒径分析该选谁?不同外泌体粒径分析技术间的比较
发布日期:2021-04-14
测量外泌体的粒径分布一直以来都是外泌体表征的重要组成部分。但是由于外泌体的尺寸仅为30~200 nm,所以必须借助一些特殊的检测手段才能够对这种在光学显微镜下不可视的颗粒进行观测。本篇就外泌体粒径测量技术的发展进行简述,并对不同技术的差异进行比较。
一、电镜技术
在外泌体发现的早期,由于还没有专门针对这类尺寸颗粒的分析方法,因此直接在电镜下面观察粒径并统计成为了早的外泌体粒径统计方法。但是这种方法费时费力,且通量低,在面对临床和科研中的大量样本时显得十分无力。

文献中外泌体在电镜TEM模式下的经典形态
二、动态光散射技术 & 纳米粒子跟踪分析技术
由于外泌体与材料学所合成的脂质体在形态上十分相似,因此用于脂质体表征的动态光散射技术(DLS)便被应用于外泌体的尺寸测量上。DLS利用光射到远小于其波长的小颗粒上时会产生瑞利散射现象,通过观察散射光的强度随时间的变化推算出溶液中颗粒的大小。但是这种技术会受到测量物质的颜色、电性、磁性等理化特性的影响,并且对于灰尘和杂质十分敏感。因此使得DLS在测量尺寸较小的粒子时,测量出的粒径与实际的分布具有较大的偏差。
为了弥补DLS的短板,纳米粒子跟踪分析(NTA)技术孕育而生。这种技术采用激光散射显微成像技术,用于记录纳米粒子在溶液中的布朗运动轨迹,并通过Stokes-Einstein方程推算粒子大小。这种技术能够对30~1000 nm的粒径进行测量,因此能够提供更为精确地粒径数据。在诸多文献的测试中均取得了较DLS更好的精度,因此成为目前为主流的外泌体尺寸测量手段。
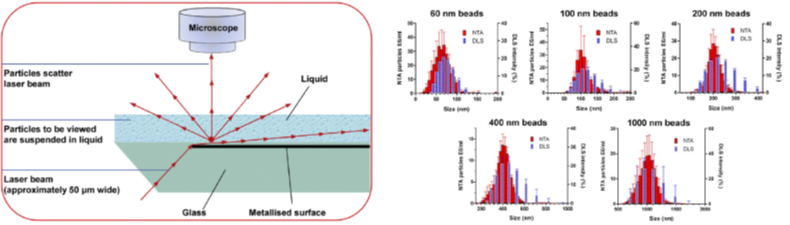
NTA技术的工作原理与DLS技术在测量不同尺寸纳米球的数据对比。可见相比于DLS,NTA测量的粒径分布更为精确。
虽然NTA取得了比DLS 更高的精准性,但是随着外泌体研究的深入,其局限性也十分明显。首先NTA仅能够测量溶液中颗粒的平均粒径尺寸,但是NTA无法分辨其中的外泌体、囊泡、脂蛋白,也不能区别不同源性的外泌体。这直接限制了外泌体粒径表征的意义,使得研究者很难探究外泌体尺寸与外泌体来源之间的关系。另外NTA本身对于测试时的温度、浓度和校准都有着较高要求,因此使得NTA在测试较小的粒子时其精度仍不能达到令人满意的效果,其测试结果却仍与电镜、AFM等成像技术所观测到的粒径存在着明显差异。
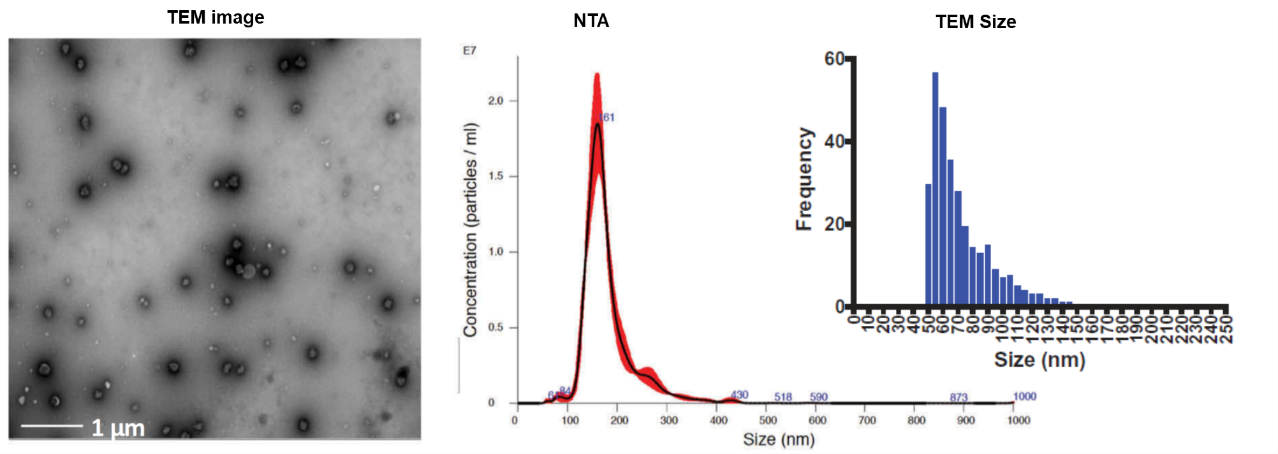
外泌体在TEM下的成像及粒径统计与NTA测量的结果对比。可见NTA测量到的粒径要比TEM直接测量的结果大50~100 nm。
三、单粒子干涉反射成像技术
为了解决上述在实际测试中的问题,一种新型的单粒子干涉反射成像传感器(SP-IRIS)技术孕育而生。这种技术摒弃了布朗运动轨迹追踪方法,通过基底与颗粒形成的相干光进行成像,通过成像后的亮度来直接计算纳米粒子的大小。从而避免了NTA测量粒径轨迹误差大的短板,拥有更高的灵敏度和精度,即使对于NTA无法区分的40 nm与70 nm的粒子混合溶液也依然能够取得很好的分辨率。
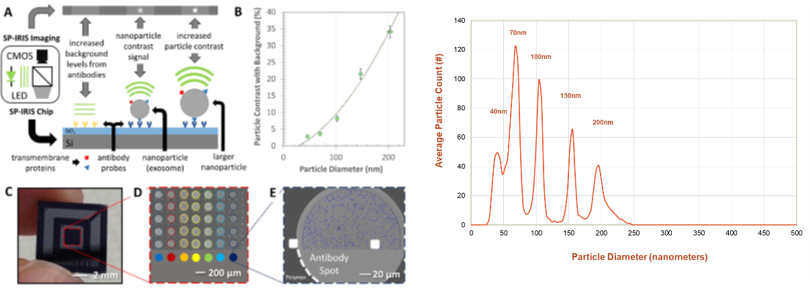
SP-IRIS的原理及芯片微阵列打印的成像效果和对混合不同粒径小球的区分效果。可见SP-IRIS技术拥有更高的测试通量和测量精度。
得益于这种高精度测量方法,越来越多的研究者终于能够测量到与电镜直接观测相当的粒径。这种优势所带来的效果不单单是能够让TEM的数据与纳米粒子表征的数据更为一致,同时还能够表征不同来源的外泌体之间的粒径差异。
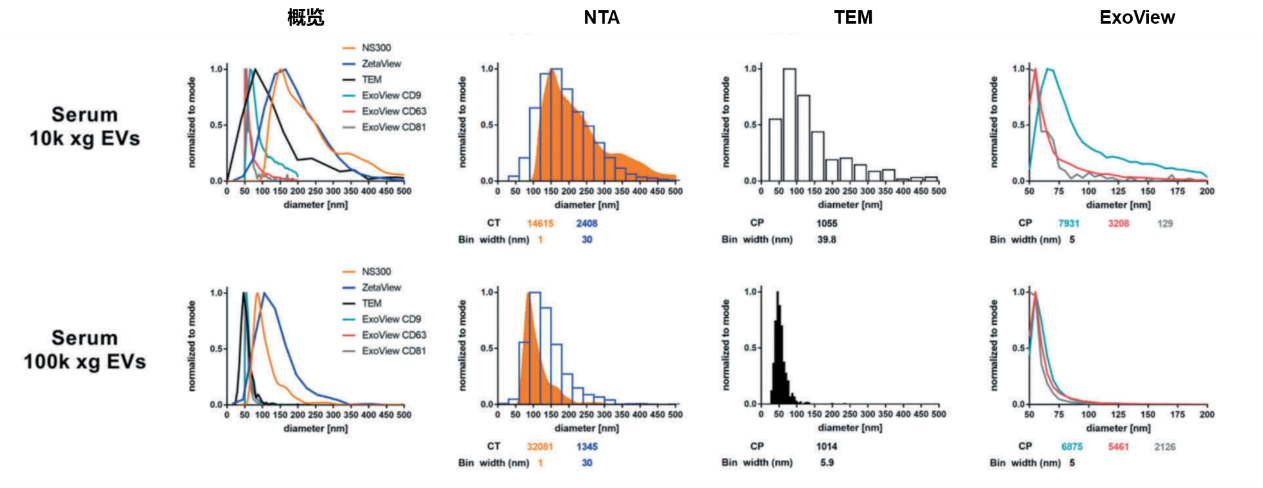
SP-IRIS、NTA和TEM统计同一样品时所测量的粒径分布。SP-IRIS在测量不同尺寸的外泌体时,测量的粒径与TEM的尺寸统计基本一致,而NTA统计的粒径则比TEM大约50 nm。此外SP-IRIS技术还能够提供不同来源外泌体的尺寸差异,能够看出CD9来源的外泌体要比其它来源的外泌体大~10 nm。
SP-IRIS的另一个优势在于能够更换激光源的波长,因此除了能够实现外泌体的形貌成像外,还能够实现单外泌体的荧光成像。使得单外泌体的荧光共定位成为可能,研究者通过这种单外泌体荧光成像能够研究单外泌体的表型、载物、来源等生物信息。
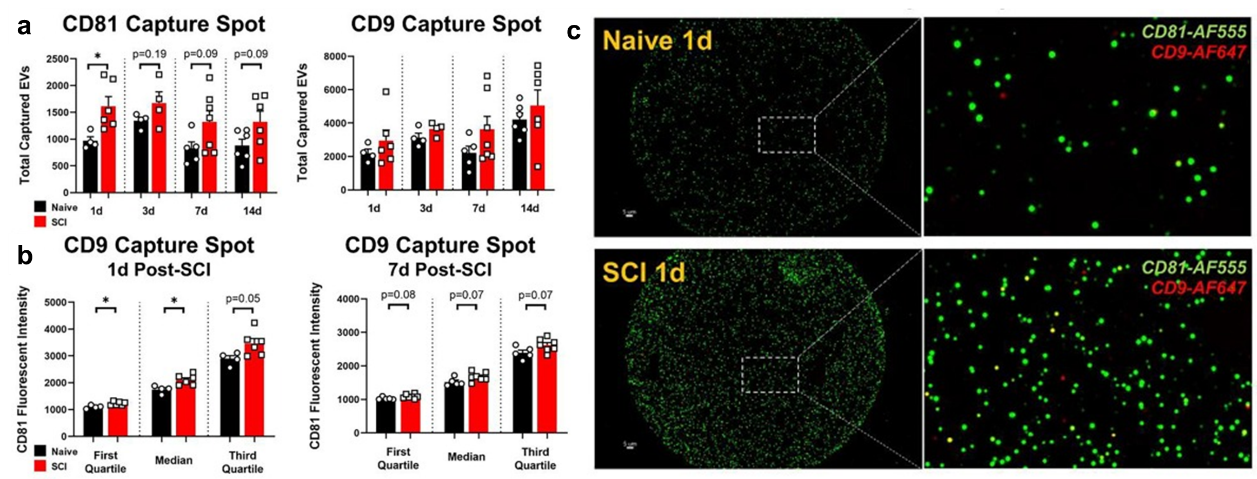
使用SP-IRIS 对受伤组和对照组小鼠不同时间点的血清CD9、CD81来源外泌体的分泌量监测。可以看到CD81来源的外泌体的分泌量呈现先增加后减少的趋势,而CD9来源的外泌体分泌量则一直在增加。
综上所述,由于SP-IRIS技术的高精度、高灵敏度、可做单外泌体荧光成像的优势,目前有越来越多的学者开始对比NTA技术和SP-SPIS技术,其结果均认为SP-SPIS技术测试的效果要明显优于NTA,这其中也不乏Cell等高水平期刊。相信在不久的将来,SP-IRIS技术将会越来越普及,为研究者研究外泌体打开新的大门。
参考文献:
[1]. Ayuko Hoshino, et al, Extracellular Vesicle and Particle Biomarkers Define Multiple Human Cancers,cell, 2020, 182, 1–18.
[2]. Oguzhan Avci, et al., Interferometric Reflectance Imaging Sensor (IRIS)—A Platform Technology for Multiplexed Diagnostics and Digital Detection, Sensors 2015, 15, 17649-17665.
[3]. George G. Daaboul, et al, Digital Detection of Exosomes by Interferometric Imaging, Scientific Reports,6, 37246.
[4]. Federica Collino, et al, Extracellular Vesicles Derived from Induced Pluripotent Stem Cells Promote Renoprotection in Acute Kidney Injury Model, Cells 2020, 9, 453.
[5]. Daniel Bachurski, et al, Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView, JOURNAL OF EXTRACELLULAR VESICLES 2019, 8, 1596016.
[6]. Robert D. Boyd, et al, New approach to inter-technique comparisons for nanoparticle size measurements; using atomic force microscopy, nanoparticle tracking analysis and dynamic light scattering, Colloids and Surfaces A: Physicochem. Eng. Aspects 387,2011, 35– 42.
